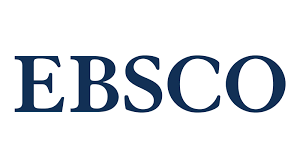Автоімунний ANA-асоційований увеїт на тлі реактивованої HHV-7-інфекції у пацієнта з первинним дефіцитом маннозозв’язуючого лектину
DOI:
https://doi.org/10.31288/oftalmolzh202066469Ключові слова:
увеїт, вірус герпесу 7 типу людини, дефіцит маннозозв’язучого лектинуАнотація
В даній статті наведено опис розвитку білатерального ANA-позитивного автоімунного увеїту у пацієнтки з первинним тотальним дефіцитом маннозозв’язучого лектину під час реактивації вірусу герпесу 7 типу людини (HHV-7) із стану латентності у слинних залозах. Діагноз увеїту було підтверджено на підставі результатів офтальмологічного огляду, даних оптичної когерентної томографії та визначення титру антинуклеарних автоантитіл у сироватці крові (1:320). Реактивацію HHV-7 із стану персистенції верифікували за допомогою ПЛР лейкоцитів крові і змиву з очей. Діагноз первинного дефіциту маннозозв’язучого лектину виставили на підставі результатів ELISA та спеціального генетичного тестування. Сироваткова концентація маннозозв’язучого лектину дорівнювала нулю, хоча всі інші вивчені показники імунного статусу перебували в межах референтних величин. За результатами генетичних тестів було ідентифіковано три патологічних заміни нуклеотидів в гені MBL-2: 223 С/Т, 230 G/A, 239 A/G, що вказувало на генетичну природу виявленого імунодефіциту.
Отримані дані дозволили призначити комплексне лікування з пригніченням автоімунного процесу за допомогою ритуксимабу і метотрексату, усуненням ДНК HHV-7 із лейкоцитів крові і змивів з очей шляхом застосування валганцикловіру та компенсацією первинного імунодефіциту замісною імунотерапією препаратом кріоконсервованої плазми крові, що містить донорські молекули маннозозв’язучого лектину. Такий різнобічний підхід дозволив не тільки швидко досягти повної ремісії увеїту, але і компенсувати інші автоімунні, алергічні та інфекційні прояви наявного імунодефіциту.
Дані цієї публікації розширюють сучасні уявлення про гетерогенність клінічних проявів первинного дефіциту маннозозв’язуючого лектину у людей та розкривають шлях до вивчення нових потенційних патогенетичних механізмів формування автоімунних уражень при цій поширеній в популяції генетичній імунній дисфункції.
Посилання
1.Sève P, Kodjikian L, Adélaïde L, Jamilloux Y. Uveitis in adults: What do rheumatologists need to know? Joint Bone Spine. 2015 Oct;82(5):308-14. https://doi.org/10.1016/j.jbspin.2015.06.002
2.Pleyer U, Winterhalter S. Diagnostic and therapeutic aspects of herpes virus associated uveitis. Klin Monbl Augenheilkd. 2010 May;227(5):407-12. doi: 10.1055/s-0029-1245338. German. https://doi.org/10.1055/s-0029-1245338
3.Alstadhaug KB, Kvarenes HW, Prytz J, Vedeler C. A case of relapsing-remitting facial palsy and ipsilateral brachial plexopathy caused by HSV-1. J Clin Virol. 2016 May;78:62-5. Ukrainian. https://doi.org/10.1016/j.jcv.2016.03.003
4.Tang YW, Cleavinger PJ, Li H, et al. Analysis of candidate-host immunogenetic determinants in herpes simplex virus-associated Mollaret's meningitis. Clin Infect Dis. 2000 Jan;30(1):176-8.https://doi.org/10.1086/313616
5.Maltsev DV. [Mannose binding lectin deficiency]. Ukrainskyi tetapevtychnyi zhurnal. 2015; 1:80-9. Ukrainian.
6.Maltsev DV, Hurzhii OO. Toxoplasma chorioretinitis in primary myeloperoxidase MPO deficiency: A case report. J Ophthalmol. (Ukraine). 2019;4:75-81.https://doi.org/10.31288/oftalmolzh201947581
7.Krichevskaia GI, Katargina LA. [Viral and non-viral infections in the etiopathogenesis of uveitis]. Vestn Oftalmol. 2020;136(1):124-9.https://doi.org/10.17116/oftalma2020136011124
8.Heiligenhaus A, Klotsche J, Niewerth M, et al. Similarities in clinical course and outcome between juvenile idiopathic arthritis (JIA)-associated and ANA-positive idiopathic anterior uveitis: data from a population-based nationwide study in Germany. Arthritis Res Ther. 2020 Apr 15;22(1):81.https://doi.org/10.1186/s13075-020-02166-3
9.Leite JL, Bufalo NE, Santos RB, et al. Herpesvirus type 7 infection may play an important role in individuals with a genetic profile of susceptibility to Graves' disease. Eur J Endocrinol. 2010 Feb;162(2):315-21.https://doi.org/10.1530/EJE-09-0719
10.Dyachenko P, Dyachenko A., Smiianova O, et al. Identification of human herpesvirus 7 in the cerebrospinal fluid of adult ukrainian with relapsing-remitting multiple sclerosis. A case study. Wiad Lek. 2018; 71(8):1636-8.
11.Nora-Krukle Z, Chapenko S, Logina I, et al. Human herpesvirus 6 and 7 reactivation and disease activity in multiple sclerosis. Medicina (Kaunas). 2011;47(10):527-31.https://doi.org/10.3390/medicina47100075
12.Venâncio P, Brito MJ, Pereira G, Vieira JP. Anti-N-methyl-D-aspartate receptor encephalitis with positive serum antithyroid antibodies, IgM antibodies against mycoplasma pneumoniae and human herpesvirus 7 PCR in the CSF. Pediatr Infect Dis J. 2014 Aug;33(8):882-3.https://doi.org/10.1097/INF.0000000000000408
13.Foldager L, Köhler O, Steffensen R, et al. Bipolar and panic disorders may be associated with hereditary defects in the innate immune system. J Affect Disord. 2014;164:148-54.https://doi.org/10.1016/j.jad.2014.04.017
14.Friborg JT, Jarrett RF, Koch A, et al. Mannose-binding lectin genotypes and susceptibility to Epstein-Barr virus infection in infancy. Clin Vaccine Immunol. 2010 Sep;17(9):1484-7.https://doi.org/10.1128/CVI.00527-09
15.Manuel O, Pascual M, Trendelenburg M, Meylan PR. Association between mannose-binding lectin deficiency and cytomegalovirus infection after kidney transplantation. Transplantation. 2007;83(3):359-62.https://doi.org/10.1097/01.tp.0000251721.90688.c2
16.Maltsev DV. [Mannose binding lectin deficiency]. Ukrainskyi medychnyi chasopys. 2015;2 (106):91-6. Ukrainian.
17.Segat L, Crovella S, Comar M, et al. MBL2 gene polymorphisms are correlated with high-risk human papillomavirus infection but not with human papillomavirus-related cervical cancer. Hum Immunol. 2009 Jun; 70(6):436-9.https://doi.org/10.1016/j.humimm.2009.03.006
18.Maggi F, Pifferi M, Michelucci A, et al. Torque teno virus viremia load size in patients with selected congenital defects of innate immunity. Clin Vaccine Immunol. 2011 Apr;18(4):692-4.https://doi.org/10.1128/CVI.00466-10
19.Tanha N, Troelsen L, From Hermansen ML, et al. MBL2 gene variants coding for mannose-binding lectin deficiency are associated with increased risk of nephritis in Danish patients with systemic lupus erythematosus. Lupus. 2014 Oct;23(11):1105-11.https://doi.org/10.1177/0961203314536478
20.Saevarsdottir S, Vikingsdottir T, Vikingsson A, et al. Low mannose binding lectin predicts poor prognosis in patients with early rheumatoid arthritis. A prospective study. J Rheumatol. 2001 Apr;28(4):728-34.
21.Mumcu G, Inanc N, Aydin SZ, et al. Association of salivary S. mutans colonisation and mannose-binding lectin deficiency with gender in Behçet's disease. Clin Exp Rheumatol. Mar-Apr 2009;27(2 Suppl 53):S32-6.
22.Aydin SZ, Atagunduz P, Inanc N, et al. Mannose binding lectin levels in spondyloarthropathies. J Rheumatol. 2007 Oct; 34(10):2075-7.
23.Potlukova E, Freiberger T, Limanova Z, et al. Association between low levels of Mannan-binding lectin and markers of autoimmune thyroid disease in pregnancy. PLoS One. 2013;8(12):e81755.https://doi.org/10.1371/journal.pone.0081755
24.Ramasawmy R, Spina GS, Fae KC, et al. Association of Mannose-Binding Lectin Gene Polymorphism but Not of Mannose-Binding Serine Protease 2 With Chronic Severe Aortic Regurgitation of Rheumatic Etiology. Clin Vaccine Immunol. 2008;15(6):932-6.https://doi.org/10.1128/CVI.00324-07
25.Carter S, Xie K, Knight D, et al. Granulomatous Uveitis and Conjunctivitis Due to Common Variable Immune Deficiency: A Case Report. Ocul Immunol Inflamm. 2019;27(7):1124-6.https://doi.org/10.1080/09273948.2018.1497666
26.Pasquet F, Kodjikian L, Mura F, et al. Uveitis and common variable immunodeficiency: data from the DEF-I study and literature review. Ocul Immunol Inflamm. 2012 Jun;20(3):163-70. https://doi.org/10.3109/09273948.2012.674612
27.Farhoudi A., Chavoshzadeh Z., Mir Saeid Ghazi B, et al. Recurrent infections and bilateral uveitis in a patient with CD8 deficiency. Iran J Allergy Asthma Immunol. 2005;4(1):43-5.
28.Angioi K, Terrada C, Locatelli A, et al. Ocular Manifestations of X-linked Chronic Granulomatous Disease: About Two Atypical Case Reports. Ocul Immunol Inflamm. 2015;23(6):458-61.https://doi.org/10.3109/09273948.2014.891753
29.Kubicka-Trzaska A. [Immunologic disturbances in patients with idiopathic posterior uveitis]. Klin Oczna. 2000;102(4):253-8.
30.Spârchez M, Lupan I, Delean D, et al. Primary complement and antibody deficiencies in autoimmune rheumatologic diseases with juvenile onset: a prospective study at two centers. Pediatr Rheumatol Online J. 2015 Nov 21;13:51.https://doi.org/10.1186/s12969-015-0050-8
31.Miserocchi E, Modorati G. Rituximab for noninfectious uveitis. Dev Ophthalmol. 2012;51:98-109.https://doi.org/10.1159/000336188
32.Valdimarsson H. Infusion of plasma-derived mannan-binding lectin (MBL) into MBL-deficient humans. Biochem Soc Trans. 2003 Aug;31(Pt 4):768-9.https://doi.org/10.1042/bst0310768
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2025 Д. В. Мальцев, О. О. Гуржій

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Ця робота ліцензується відповідно до ліцензії Creative Commons Attribution 4.0 International (CC BY). Ця ліцензія дозволяє повторно використовувати, поширювати, переробляти, адаптувати та будувати на основі матеріалу на будь-якому носії або в будь-якому форматі за умови обов'язкового посилання на авторів робіт і первинну публікацію у цьому журналі. Ліцензія дозволяє комерційне використання.
ПОЛОЖЕННЯ ПРО АВТОРСЬКІ ПРАВА
Автори, які подають матеріали до цього журналу, погоджуються з наступними положеннями:
- Автори отримують право на авторство своєї роботи одразу після її публікації та назавжди зберігають це право за собою без жодних обмежень.
- Дата початку дії авторського права на статтю відповідає даті публікації випуску, до якого вона включена.
ПОЛІТИКА ДЕПОНУВАННЯ
- Редакція журналу заохочує розміщення авторами рукопису статті в мережі Інтернет (наприклад, у сховищах установ або на особистих веб-сайтах), оскільки це сприяє виникненню продуктивної наукової дискусії та позитивно позначається на оперативності і динаміці цитування.
- Автори мають право укладати самостійні додаткові угоди щодо неексклюзивного розповсюдження статті у тому вигляді, в якому вона була опублікована цим журналом за умови збереження посилання на первинну публікацію у цьому журналі.
- Дозволяється самоархівування постпринтів (версій рукописів, схвалених до друку в процесі рецензування) під час їх редакційного опрацювання або опублікованих видавцем PDF-версій.
- Самоархівування препринтів (версій рукописів до рецензування) не дозволяється.