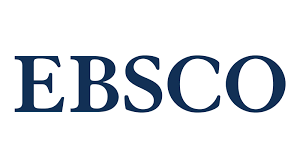Структурні зміни рогівки, виявлені за допомогою конфокальної мікроскопії у пацієнтів з кератоконусом після прискореного кросслінкінгу
DOI:
https://doi.org/10.31288/oftalmolzh202022429Ключові слова:
кератоконус, конфокальна мікроскопія, кросслінкінгАнотація
Актуальність. Біомікроскопічні зміни рогівки у пацієнтів, хворих на кератоконус, після кросслінкінгу (CLX) можливо виявити за допомогою конфокальної мікроскопії (КМ). В літературі зустрічаються поодинокі повідомлення про морфологічні зміни рогівки після CLX.
Метою нашого дослідження було виявлення структурних змін рогівки за допомогою КМ після прискореного CLX у хворих на кератоконус.
Матеріал та методи. В нашому дослідженні на 167 очах хворих на кератоконус після прискореного CLX виявленні структурні зміни рогівки за допомогою КМ в терміни спостереження до 12 міс після операції. Процедура прискоренного CXL виконувалася за допомогою приладу UV-X ™ 2000 з потужністю випромінювання 9 mW/см². Конфокальна біомикроскопія проводилась на приладі «Confoscan 4» (Nidek, Японія).
Результати. Процедура акселерованого (10 хвилин) CLX при прогресуючому кератоконусі 2-3 стадій являється безпечною та приводить до стабілізації кератоконуса в терміни спостереження 12 місяців після операції. Через 3 місяці після процедури прискореного CLX зафіксовано активне відновлення кератоцитів в глибоких і поверхневих шарах строми з розсмоктуванням вогнищ фіброзу. Відновлення нормальної архітектоніки рогівки починається через 6 міс після прискореного кросслінкінгу та репополюзація кератоцитів завершається через 12 місяців за даними КМ.
Посилання
1.Bikbov MM, Surkova VK. [Corneal collagen crosslinking for keratoconus]. A review. Ophthalmology in Russia. 2014;11(3):13-8. Russian.
2.Birich TA, Chekina AIu, Aksionova NI. [Outcomes of treatment for keratoconus]. Oftalmologiia Belorusi. 2010;1(4):90-7. Russian.
3.Ivanovskaia EV, Vit VV, Golovchenko VG. [Immunological status of patients with various stages of keratoconus and keratoglobus]. Oftalmol Zh. 2000;5:40-4. Russian.
4.Sevastiianov EN, Gorskova EN, Ekgard VF. [Keratoconus (etiology, pathogenesis, medicinal treatment): textbook]. Cheliabinsk: UGMADO;2005. Russian.
5.Solodkova EG, Remesnikov IA. [Modern approaches in the treatment progressive keratectasia]. Prakticheskaia meditsina. 2012;4:75-9. Russian.
6.Adel Alhayek, Pei-Rong Lu. Corneal collagen crosslinking in keratoconus and other eye disease. Int J Ophthalmol. 2015; 8(2): 407-18.doi: 10.3980/j.issn.2222-3959.2015.02.35.
7.Kohlhaas M, Spoerl E, Schilde T, et al. Biomechanical evidence of the distribution of cross-links in corneas treated with riboflavin and ultraviolet A light. J Cataract Refract Surg. 2006 Feb;32(2):279-83.https://doi.org/10.1016/j.jcrs.2005.12.092
8.Nowak DM, Gajecka M. The genetics of keratoconus. Middle East Afr J Ophthalmol. 2011 Jan;18(1):2-6. https://doi.org/10.4103/0974-9233.75876
9.Spoerl E, Mrochen M, Sliney D, et al. Safety of UVA - riboflavin cross - linking of the cornea. Cornea. 2007 May;26(4):385-9.https://doi.org/10.1097/ICO.0b013e3180334f78
10.Sporl E, Huhle M, Kasper M, Seiler T. [Increased rigidity of the cornea caused by intrastromal crosslinking]. Ophthalmologe. 1997 Dec;94(12):902-6. German.https://doi.org/10.1007/s003470050219
11.Vinciguerra P, Torres I, Camesasca FI. Applications of confocal microscopy in refractive surgery. J Refract Surg. 2002 May-Jun;18(3 Suppl):S378-81.https://doi.org/10.3928/1081-597X-20020502-21
12.Cavanagh HD, Petroll WM, Alizadeh H, et al. Clinical and diagnostic use of in vivo confocal microscopy in patients with corneal disease. Ophthalmology. 1993 Oct;100(10):1444-54.https://doi.org/10.1016/S0161-6420(93)31457-0
13.Somodi S, Hahnel C, Slowik C, et al. Confocal in vivo microscopy and confocal laser-scanning fluorescence microscopy in keratoconus. Ger J Ophthalmol. 1996 Nov;5(6):518-25.
14.Tsubota K, Mashima Y, Murata H, et al. Corneal epithelium in keratoconus. Cornea. 1995 Jan;14(1):77-83.https://doi.org/10.1097/00003226-199501000-00013
15.Vinciguerra P, Alb? E, Trazza S, Rosetta P, Vinciguerra R, Seiler T, et al. Refractive, topographic, tomographic, and aberrometric analysis of keratoconic eyes undergoing corneal cross-linking. Ophthalmology. 2009 Mar;116(3):369-78.https://doi.org/10.1016/j.ophtha.2008.09.048
16.Patel SV, McLaren JW, Hodge DO, et al. Normal human keratocyte density and corneal thickness measurement by using confocal microscopy in vivo. Invest Ophthal Vis Sci. 2001 Feb;42(2):333-9.
17.Chew SJ, Beuerman RW, Assouline M, et al. Early diagnosis of infectious keratitis with in vivo real time confocal microscopy. CLAO J. 1992 Jul;18(3):197-201.
18.Chiou AG, Beuerman RW, Kaufman SC, Kaufman HE. Confocal microscopy in lattice corneal dystrophy. Graefes Arch Clin Exp Ophtalmol. 1999 Aug;237(8):697-701.https://doi.org/10.1007/s004170050299
19.Chiou AG, Kaufman SC, Beuerman RW, et al. Confocal microscopy in posterior polymorphous corneal dystrophy. Ophthalmologica. 1999;213(4):211-3.https://doi.org/10.1159/000027423
20.Ciancaglini M, Carpineto P, Doronzo E, et al. Morphological evaluation of Schnyder's central crystalline dystrophy by confocal microscopy before and after phototherapeutic keratectomy. J Cataract Refract Surg. 2009 Apr;37(3):308-12.
21.Croghale NS. Epidemiology of keratoconus. Indian J Ophthalmol. 2013;61(8): 382-3.https://doi.org/10.4103/0301-4738.116054
22.Ku JY, Grupcheva CN, McGhee CN. Microstructural analysis of Salzmann's nodular degeneration by in vivo confocal microscopy. Clin Exp Ophtalmol. 2002 Oct;30(5):367-8.https://doi.org/10.1046/j.1442-9071.2002.00558.x
23.Kymionis GD, Portaliou DM, Bouzoukis DI, et al. Herpetic keratitis with iritis after corneal crosslinking with riboflavin and ultraviolet A for keratoconus. J Cataract and Refract Surg. 2007 Nov;33(11):1982-4.https://doi.org/10.1016/j.jcrs.2007.06.036
24.Rosenberg ME, Tervo TM, Muller LJ, et al. In vivo confocal microscopy after herpes keratitis. Cornea. 2002 Apr;21(3):265-9.https://doi.org/10.1097/00003226-200204000-00006
25.Rosenberg ME, Tervo TM, Immonen IJ, et al. Corneal structure and sensitivity in type 1 diabetes mellitus. Invest Ophthalmol Vis Sci. - 2000;41:2915-21.
26.Rothstein A, Auran J, Wittpenn J. et al. Confocal microscopy in Meretoja syndrome. Cornea. 2002 May;21(4):364-7.
https://doi.org/10.1097/00003226-200205000-00007
27.Spoerl E, Huhle M, Seiler T. Induction of cross-links in corneal tissue. Exp Eye Res. 1998 Jan;66(1):97-103.https://doi.org/10.1006/exer.1997.0410
28.Spoerl E, Seiler T J. Techniques for stiffening the cornea. Refract Surg. 999 Nov-Dec;15(6):711-3.
29.Brookes NH, Loh IP, Clover GM, et al. Involvement of corneal nerves in the progression of keratoconus. Exper Eye Res. 2003;77:515-24.https://doi.org/10.1016/S0014-4835(03)00148-9
30.Hollingsworth JG, Efron N, Tullo AB. In vivo corneal confocal microscopy in keratoconus. Ophthalmic Physiol Opt. 2005 May;25(3):254-60.https://doi.org/10.1111/j.1475-1313.2005.00278.x
31.Simo Mannion L, Tromans C, O'Donnell C. An evaluation of corneal nerve morphology and function in moderate keratoconus. Cont Lens Anterior Eye. 2005 Dec;28(4):185-92. Epub 2005 Nov 21.https://doi.org/10.1016/j.clae.2005.10.005
32.Patel DV, McGhee CN. Mapping the corneal sub-basal nerve plexus in keratoconus by in vivo laser scanning confocal microscopy. Invest Ophthalmol Vis Sci. 2006;47:1348-51.https://doi.org/10.1167/iovs.05-1217
33.Rabinowitz YS. Keratoconus. Surv Ophthalmol. 1998 Jan-Feb;42(4):297-319.https://doi.org/10.1016/S0039-6257(97)00119-7
34.McQuaid R, Cummings AB, Mrochen M. The theory and art of corneal cross-linking. Indian J Ophthalmol. 2013 Aug;61(8):416-9.https://doi.org/10.4103/0301-4738.116069
35.Avetisov SE, Egorov EA, Moshetova LK, et al. [Ophthalmology: National Guidance]. GEOTAR-Media: Moscow; 2018. Russian.
36.Mazzotta C, Traversi C, Baiocchi S, Caporossi O, Bovone C, Sparano MC, et al. Corneal healing after riboflavin ultraviolet-A collagen cross-linking determined by confocal laser scanning microscopy in vivo: Early and late modifications. Am J Ophthalmol. 2008 Oct;146(4):527-533.https://doi.org/10.1016/j.ajo.2008.05.042
37.Mazzotta C, Hafezi F, Kymionis G, et al. In Vivo Confocal Microscopy after Corneal Collagen Crosslinking. Ocul Surf. 2015 Oct;13(4):298-314.https://doi.org/10.1016/j.jtos.2015.04.007
38.Touboul D, Efron N, Smadja D, et al. Corneal confocal microscopy following conventional, transepithelial, and accelerated corneal collagen cross-linking procedures for keratoconus. J Refract Surg. 2012 Nov;28(11):769-76.https://doi.org/10.3928/1081597X-20121016-01
39.Zare MA, Mazloumi M, Farajipour H, et al. Effects of corneal collagen crosslinking on confocal microscopic findings and tear indices in patients with progressive keratoconus. Int J Prev Med. 2016 Dec; 23(7): 132.https://doi.org/10.4103/2008-7802.196527
40.Wasilewski D, Mello GH, Moreira H. Impact of collagen crosslinking on corneal sensitivity in keratoconus patients. Cornea. 2013 Jul;32(7):899-902.https://doi.org/10.1097/ICO.0b013e31827978c8
41.Knappe S, Stachs O, Zhivov A, et al. Results of confocal microscopy examinations after collagen cross-linking with riboflavin and UVA light in patients with progressive keratoconus. Ophthalmologica. 2011;225(2):95-104.https://doi.org/10.1159/000319465
42.Macsai MS, Varley GA, Krachmer JH. Development of keratoconus after contact lens wear. Patient characteristics. Arch Ophthalmol. 1990 Apr;108(4):534-8.https://doi.org/10.1001/archopht.1990.01070060082054
43.Mazzotta C, Balestrazzi A, Traversi C, et al. Treatment of progressive keratoconus by riboflavin-UVA-induced cross-linking of corneal collagen; ultrastructural analysis by Heidelberg Retinal Tomograph II in vivo confocal microscopy in humans. Cornea. 2007 May;26(4):390-7.https://doi.org/10.1097/ICO.0b013e318030df5a
44.Meek KM, Tuft SJ, Huang Y, et al. Changes in collagen orientation and distribution in keratoconus. Invest Ophthalmol Vis Sci. 2005. 2005 Jun;46(6):1948-56.https://doi.org/10.1167/iovs.04-1253
45.Wollensak G, Spoerl E, Seiler T. Riboflavin/ultraviolet-a-induced collagen crosslinking for the treatment of keratoconus. Am J Ophthalmol. - 2003 May;135(5):620-7.https://doi.org/10.1016/S0002-9394(02)02220-1
46.Wollensak G, Spoerl E, Seiler T.. Stress-strain measurements of human and porcine corneas after riboflavinultraviolet - A-induced cross-linking. J Cataract Refract Surg. 2003 Sep;29(9):1780-5.https://doi.org/10.1016/S0886-3350(03)00407-3
47.Werner LP, Issid K, WernerL, et al. Salzmann's corneal degeneration associated with epithelial basement membrane dystrophy. Cornea. 2000 Jan;19(1):121-3.https://doi.org/10.1097/00003226-200001000-00024
48.Winchester K, Mathers WD, Sutphin JE, et al. Diagnosis of Acanthamoeba keratitis in vivo with confocal microscopy. Cornea. 1995 Jan;14(1):10-7.https://doi.org/10.1097/00003226-199501000-00003
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2025 Л. Ф. Тройченко, К. В. Середа, Г. І. Дрожжина, О. М. Іванова, Н. В. Медведовська

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Ця робота ліцензується відповідно до ліцензії Creative Commons Attribution 4.0 International (CC BY). Ця ліцензія дозволяє повторно використовувати, поширювати, переробляти, адаптувати та будувати на основі матеріалу на будь-якому носії або в будь-якому форматі за умови обов'язкового посилання на авторів робіт і первинну публікацію у цьому журналі. Ліцензія дозволяє комерційне використання.
ПОЛОЖЕННЯ ПРО АВТОРСЬКІ ПРАВА
Автори, які подають матеріали до цього журналу, погоджуються з наступними положеннями:
- Автори отримують право на авторство своєї роботи одразу після її публікації та назавжди зберігають це право за собою без жодних обмежень.
- Дата початку дії авторського права на статтю відповідає даті публікації випуску, до якого вона включена.
ПОЛІТИКА ДЕПОНУВАННЯ
- Редакція журналу заохочує розміщення авторами рукопису статті в мережі Інтернет (наприклад, у сховищах установ або на особистих веб-сайтах), оскільки це сприяє виникненню продуктивної наукової дискусії та позитивно позначається на оперативності і динаміці цитування.
- Автори мають право укладати самостійні додаткові угоди щодо неексклюзивного розповсюдження статті у тому вигляді, в якому вона була опублікована цим журналом за умови збереження посилання на первинну публікацію у цьому журналі.
- Дозволяється самоархівування постпринтів (версій рукописів, схвалених до друку в процесі рецензування) під час їх редакційного опрацювання або опублікованих видавцем PDF-версій.
- Самоархівування препринтів (версій рукописів до рецензування) не дозволяється.