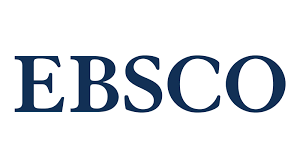Рівень маркерів нейрозапалення в пацієнтів на діабетичну ретинопатію на фоні цукрового діабету 2-го типу та генетично детермінованої гіпергомоцистеїнемії
DOI:
https://doi.org/10.31288/oftalmolzh202442837Ключові слова:
цитокіни, ненейрональна енолаза, сітківка, проліферативна діабетична ретинопатіяАнотація
Вступ. Гіпергомоцистеїнемія внаслідок поліморфізмів генів, що кодують синтез ферментів фолатного циклу, тісно корелює з маркерами системного запалення. Хронічна гіперпродукція цитокінів у нервовій тканині пацієнтів з цукровим діабетом 2-го типу (ЦД2) викликає гліоз і є загрозою виникнення нейрозапалення, яке може бути важливою патогенетичною ланкою діабетичної ретинопатії (ДР).
Мета роботи – дослідити рівень маркерів нейрозапалення (IL-1b, IL-10) й маркеру гліозу (ненейрональної енолази, NNE) у пацієнтів на ДР на фоні ЦД2 типу та генетично детермінованої гіпергомоцистеїнемії.
Матеріал та методи. Під спостереженням було 106 пацієнтів із ЦД2 та ДР. Стадія ДР визначена відповідно до шкали ETDRS: непроліферативна (level 47–53е), проліферативна (level 61–75) та прогресуюча (level 81–85). Контрольну групу (КГ) склали 64 особи, які були порівняні за віком, статтю, способом життя з пацієнтами. Усім встановили генотип генів MTHFR C677T (rs1801133); MTHFR A1298C (rs1801131); MTR A2756G (rs1805087) з використанням системи TaqMan® SNP Genotyping Assay (США) на ампліфікаційній системі Applied Biosystems 7500 RealTime PCR System (США). Шляхом твердофазного імуно-ферментного аналізу визначили вміст L-гомоцистеїну, цитокінів та енолази.
Результати. Виявили підвищення в 1,7 раза (р<0,05) цитокіну IL-1b у пацієнтів з ДР, у яких ЦД2 триває менше 15 років, порівняно з хворими з більшою тривалістю основного захворювання. Вміст енолази також був дещо вище в цій групі пацієнтів, але без статистично значущої різниці. Виявлена кореляція рівня L-гомоцистеїну з IL-1b (R = 0,320, p <0,01), із IL-10 на рівні (R = 0,357, p <0,01) та з NNE (R = 0,286, p <0,01). Виявлений кореляційний зв'язок NNE з цитокінами на рівні (R = 0,279, p <0,01) із IL-10 та (R = 0,368, p <0,01) із IL-1b.
Висновок. Підвищення рівня прозапальних цитокінів у плазмі крові пацієнтів свідчить про значну роль нейрозапалення в патогенезі ДР. Носійство генотипів: СС гену rs1801133, GG гену rs1805087, СС гену rs1801131 можна вважати фактором ризику розвитку ДР на тлі ЦД2.
Посилання
Mikheytseva IM. Current View On Pathogenic Mechanisms Of Diabetic Retinopathy. Fiziol Zh. 2023; 69(3): 106-114. https://doi.org/10.15407/fz69.03.106
Gardner TW, Davila JR. The neurovascular unit and the pathophysiologic basis of diabetic retinopathy. Graefes Arch. Clin. Exp. Ophthalmol. 2017; 255: 1-6. https://doi.org/10.1007/s00417-016-3548-y
Nian S, Lo ACY, Mi Y, Ren K, Yang D. Neurovascular unit in diabetic retinopathy: Pathophysiological roles and potential therapeutical targets. Eye Vis. 2021; 8:15. https://doi.org/10.1186/s40662-021-00239-1
Bianco L, Arrigo A, Aragona E, Antropoli A, Berni A, Saladino A, et al. Neuroinflammation and neurodegeneration in diabetic retinopathy. Front Aging Neurosci. 2022; Aug 16;14:937999. https://doi.org/10.3389/fnagi.2022.937999
Solomon SD, Chew E, Duh EJ, Sobrin L, Sun JK, VanderBeek B., et al. Diabetic retinopathy: A position statement by the American Diabetes Association. Diabetes Care. 2017; 40: 412-418.
https://doi.org/10.2337/dc16-2641
Hawkins BT, Davis TP. The blood-brain barrier/neurovascular unit in health and disease. Pharmacol. Rev. 2005; 57: 173-185. https://doi.org/10.1124/pr.57.2.4
Antonetti DA, Klein R, Gardner TW. (Diabetic retinopathy. N. Engl. J. Med. 2012; 366: 1227-1239. https://doi.org/10.1056/NEJMra1005073
Luzzi S, Cherubini V, Falsetti L, Viticchi G, Silvestrini M, Toraldo A. Homocysteine, Cognitive Functions, and Degenerative Dementias: State of the Art. Biomedicines. 2022; Oct 28;10(11):2741. https://doi.org/10.3390/biomedicines10112741
Ansari R, Mahta A, Mallack E, Luo JJ. Hyperhomocysteinemia and neurologic disorders: a review. J Clin Neurol. 2014 Oct; 10(4):281-8. https://doi.org/10.3988/jcn.2014.10.4.281
Quan Y, Xu J, Xu Q, Guo Z, Ou R, Shang H, Wei Q. Association between the risk and severity of Parkinson's disease and plasma homocysteine, vitamin B12 and folate levels: a systematic review and meta-analysis. Front Aging Neurosci. 2023 Oct 24;15:1254824. https://doi.org/10.3389/fnagi.2023.1254824
Kowluru RA, Mohammad G, Sahajpal N. Faulty homocysteine recycling in diabetic retinopathy. Eye Vis (London). 2020;7:4. https://doi.org/10.1186/s40662-019-0167-9
Gu J, Lei C, Zhang M. Folate and retinal vascular diseases. BMC Ophthalmol. 2023 Oct 13;23(1):413. https://doi.org/10.1186/s12886-023-03149-z
Rykov SO, Prokopenko IuV, Natrus LV, Panchenko IuO. Role of polymorphisms of folate-cycle enzymes in diabetic retinopathy progression in patients with type 2 diabetic mellitus. Journal of Ophthalmology (Ukraine). 2022; 5:3-11. https://doi.org/10.31288/oftalmolzh20225311
Malaguarnera G, Gagliano C, Salomone S, Giordano M, Bucolo C, Pappalardo A, Drago F, Caraci F, Avitabile T, Motta M. Folate status in type 2 diabetic patients with and without retinopathy. Clin Ophthalmol. 2015 Aug 7;9:1437-42. https://doi.org/10.2147/OPTH.S77538
Maltsev D, Kurchenko A, Marushko Y, Yuriev S. Biochemical profile of children with autism spectrum disorders associated with genetic deficiency of the folate cycle. Biochimica Clinica. 2023; 47(2): 132-140.
Marangos PJ, Schmechel D, Zis AP, Goodwin FK. The existence and neurobiological significance of neuronal and glial forms of the glycolytic enzyme enolase. Biol Psychiatry. 1979, Aug;14(4):563-79.
Davis M, Fisher M, Gangnon R, et al. Risk factors for high-risk proliferative diabetic retinopathy and severe visual loss: Early Treatment Diabetic Retinopathy Study Report 18. Invest Ophthalmol Vis Sci. 1998; 39: 233-52.
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2024 Панченко Ю. О., Цибульський В. С., Натрус Л. В., Захаревич Г. Є.

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Ця робота ліцензується відповідно до ліцензії Creative Commons Attribution 4.0 International (CC BY). Ця ліцензія дозволяє повторно використовувати, поширювати, переробляти, адаптувати та будувати на основі матеріалу на будь-якому носії або в будь-якому форматі за умови обов'язкового посилання на авторів робіт і первинну публікацію у цьому журналі. Ліцензія дозволяє комерційне використання.
ПОЛОЖЕННЯ ПРО АВТОРСЬКІ ПРАВА
Автори, які подають матеріали до цього журналу, погоджуються з наступними положеннями:
- Автори отримують право на авторство своєї роботи одразу після її публікації та назавжди зберігають це право за собою без жодних обмежень.
- Дата початку дії авторського права на статтю відповідає даті публікації випуску, до якого вона включена.
ПОЛІТИКА ДЕПОНУВАННЯ
- Редакція журналу заохочує розміщення авторами рукопису статті в мережі Інтернет (наприклад, у сховищах установ або на особистих веб-сайтах), оскільки це сприяє виникненню продуктивної наукової дискусії та позитивно позначається на оперативності і динаміці цитування.
- Автори мають право укладати самостійні додаткові угоди щодо неексклюзивного розповсюдження статті у тому вигляді, в якому вона була опублікована цим журналом за умови збереження посилання на первинну публікацію у цьому журналі.
- Дозволяється самоархівування постпринтів (версій рукописів, схвалених до друку в процесі рецензування) під час їх редакційного опрацювання або опублікованих видавцем PDF-версій.
- Самоархівування препринтів (версій рукописів до рецензування) не дозволяється.