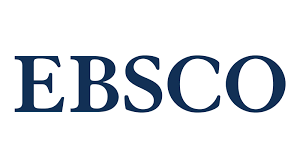Стан S100-позитивної глії та вплив на неї агоністу ГАМК-бензодіазепінових рецепторів карбацетаму при діабетичній ретинопатії
DOI:
https://doi.org/10.31288/oftalmolzh202433339Ключові слова:
діабетична ретинопатія, нейродегенерація, бензодіазепіновий рецептор, імуногістохімія, стрептозотоцин, клітини Мюллера, білок S100, сітківкаАнотація
Мета дослідження – встановлення стану S100-позитивної глії та впливу на неї агоністу ГАМК-бензодіазепінових рецепторів карбацетаму на початкових стадіях розвитку експериментальної діабетичної ретинопатії (ДР).
Матеріал та методи. У 30 трьохмісячних щурів-самців лінії Wistar моделювали ДР шляхом одноразового введення стрептозотоцину (50 мг/кг; Sigma-Aldrich, Co, China). Щурів було розподілено на 3 групи (по 10 тварин): контрольна, з введенням інсуліну (30 Од; NovoNordiskA/S, Bagsvaerd, Denmark) і з введенням інсуліну і карбацетаму (5 мг/кг). Для визначення початкових даних використано 5 інтактних тварин. Імуногістохімічно у сітківці виявляли білок S100 (Monoclonal Antibody; ThermoFisherScietific, USA).
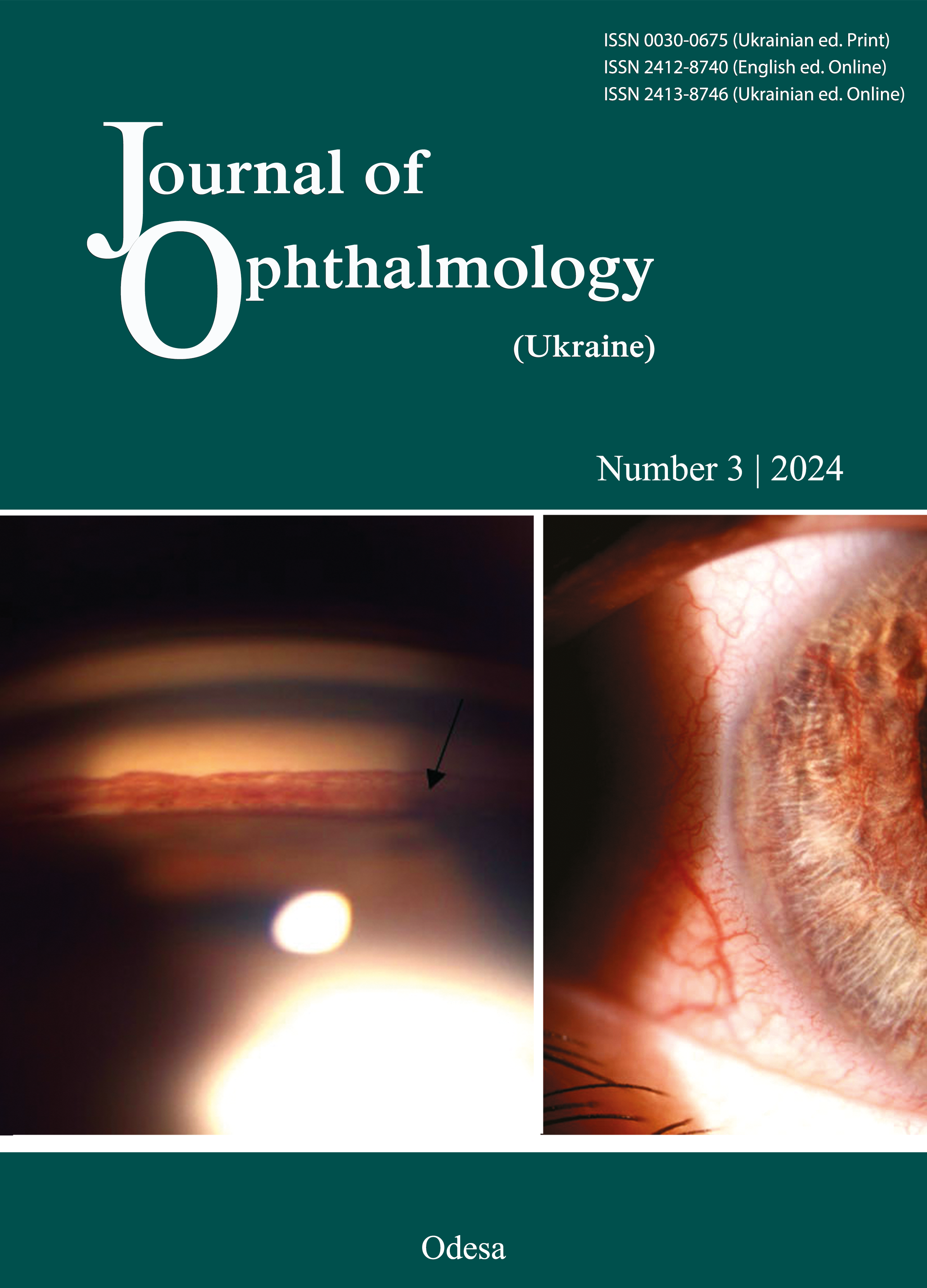
Результати. В інтактній сітківці S100-позитивне забарвлення мали тіла багаточисельних поліморфних клітин внутрішнього ядерного шару, та гліальні волокна, що муфтоподібно охоплювали гангліонарні нейрони. При розвитку ДР інтенсивність S100-позитивного забарвлення клітин Мюллера значно зростала, чітко візуалізовалися їх довгі радіальні відростки. Інтенсивне забарвлення відмічено у зовнішньому ядерному шарі та на його межі з шаром паличок і колбочок, а також – у шарі гангліонарних клітин. На 28-у добу у внутрішніх шарах сітківки виявлялися мікроаневризми, з якими щільно контактували інтенсивно забарвлені S100-позитивні волокна. Застосування інсуліну приводило к послабленню інтенсивності S100-позитивного забарвлення, а комбіноване введення інсуліну і карбацетаму гальмувало експресію білка S100 і запобігало утворенню мікроаневризм сітківки: на 28-у добу забарвлення слабкої інтенсивності зберігалося тільки у поодиноких клітинах Мюллера внутрішнього ядерного шару та у сплетінні волокон гангліонарного шару.
Висновок. Таким чином, встановлено гальмівний ефект агоністу бензодіазепінових рецепторів карбацетаму на експресію білка S100 та утворення мікроаневризм сітківки на початкових стадіях розвитку ДР при стрептозотоцин-індукованому діабеті у щурів.
Посилання
Solomon SD, Chew E, Duh EJ, Sobrin L, Sun JK, VanderBeek BL, Wykoff CC, Gardner TW. Diabetic Retinopathy: A Position Statement by the American Diabetes Association. Diabetes Care. 2017 Mar;40(3):412-418. https://doi.org/10.2337/dc16-2641
Wong TY, Sabanayagam C. Strategies to Tackle the Global Burden of Diabetic Retinopathy: From Epidemiology to Artificial Intelligence. Ophthalmologica. 2020;243(1):9-20. https://doi.org/10.1159/000502387
Duh EJ, Sun JK, Stitt AW. Diabetic retinopathy: current understanding, mechanisms, and treatment strategies. JCI Insight. 2017 Jul 20;2(14):e93751. https://doi.org/10.1172/jci.insight.93751
Ren J, Zhang S, Pan Y, Jin M, Li J, Luo Y, Sun X, Li G. Diabetic retinopathy: Involved cells, biomarkers, and treatments. Front Pharmacol. 2022 Aug 9;13:953691. https://doi.org/10.3389/fphar.2022.953691
Abramoff MD, Fort PE, Han IC, Jayasundera KT, Sohn EH, Gardner TW. Approach for a Clinically Useful Comprehensive Classification of Vascular and Neural Aspects of Diabetic Retinal Disease. Invest Ophthalmol Vis Sci. 2018 Jan 1;59(1):519-527. https://doi.org/10.1167/iovs.17-21873
Ou GY, Lin WW, Zhao WJ. Neuregulins in Neurodegenerative Diseases. Front Aging Neurosci. 2021 Apr 9;13:662474. https://doi.org/10.3389/fnagi.2021.662474
Van de Kreeke JA, Darma S, Chan Pin Yin JMPL, Tan HS, Abramoff MD, Twisk JWR, Verbraak FD. The spatial relation of diabetic retinal neurodegeneration with diabetic retinopathy. PLoS One. 2020 Apr 16;15(4):e0231552. https://doi.org/10.1371/journal.pone.0231552
Eggers ED. Visual Dysfunction in Diabetes. Annu Rev Vis Sci. 2023 May 10. https://doi.org/10.1146/annurev-vision-111022-123810
Fang W, Huang X, Wu K, Zong Y, Yu J, Xu H, Shi J, Wei J, Zhou X, Jiang C. Activation of the GABA-alpha receptor by berberine rescues retinal ganglion cells to attenuate experimental diabetic retinopathy. Front Mol Neurosci. 2022 Aug 9;15:930599. https://doi.org/10.3389/fnmol.2022.930599
Sawant A, Ebbinghaus BN, Bleckert A, Gamlin C, Yu WQ, Berson D, Rudolph U, Sinha R, Hoon M. Organization and emergence of a mixed GABA-glycine retinal circuit that provides inhibition to mouse ON-sustained alpha retinal ganglion cells. Cell Rep. 2021 Mar 16;34(11):108858. https://doi.org/10.1016/j.celrep.2021.108858
Okumichi H, Mizukami M, Kiuchi Y, Kanamoto T. GABA A receptors are associated with retinal ganglion cell death induced by oxidative stress. Exp Eye Res. 2008 May;86(5):727-33. https://doi.org/10.1016/j.exer.2008.01.019
Aragona M, Briglia M, Porcino C, Mhalhel K, Cometa M, Germanà PG, Montalbano G, Levanti M, Laurà R, Abbate F, Germanà A, Guerrera MC. Localization of Calretinin, Parvalbumin, and S100 Protein in Nothobranchius guentheri Retina: A Suitable Model for the Retina Aging. Life (Basel). 2023 Oct 13;13(10):2050. https://doi.org/10.3390/life13102050
Lim RR, Vaidya T, Gadde SG, Yadav NK, Sethu S, Hainsworth DP, Mohan RR, Ghosh A, Chaurasia SS. Correlation between systemic S100A8 and S100A9 levels and severity of diabetic retinopathy in patients with type 2 diabetes mellitus. Diabetes Metab Syndr. 2019 Mar-Apr;13(2):1581-1589. https://doi.org/10.1016/j.dsx.2019.03.014
Al-Kuraishy HM, Al-Gareeb AI, Saad HM, Batiha GE. Benzodiazepines in Alzheimer's disease: beneficial or detrimental effects. Inflammopharmacology. 2023 Feb;31(1):221-230. https://doi.org/10.1007/s10787-022-01099-4
Kmet OG, Ziablitsev SV, Filipets ND, Kmet TI, Slobodian XV. Carbacetam effect on behavioral reactions in experimental Alzheimer's disease. Archives of the Balkan Medical Union. 2019 March; 54(1):124-129. https://doi.org/10.31688/ABMU.2019.54.1.17
Kmet OG, Ziablitsev SV, Filipets ND. Peculiarities of the antioxidant protection and nitrogen oxide systems of the brain in rats with experimental type 2 diabetes mellitus after carbacetam administration. International Journal of Endocrinology. 2019;15(5):376-380. doi: 10.22141/2224-0721.15.5.2019.180040. in Ukrainian. https://doi.org/10.22141/2224-0721.15.5.2019.180040
Kresyun NV, Son GA, Godlevskii LS. To mechanisms of retinopathy development in streptozotocin-induced diabetes against electrical stimulation of brain structures. J Ophthalmol (Ukraine). 2017;4:51-54. https://doi.org/10.31288/oftalmolzh201745154
Dabbs D. Diagnostic Immunohistochemistry, 4th Edition. Theranostic and genomic applications. 2014.
Lynch SK, Abràmoff MD. Diabetic retinopathy is a neurodegenerative disorder. Vision Res. 2017 Oct;139:101-107. https://doi.org/10.1016/j.visres.2017.03.003
Simó R, Stitt AW, Gardner TW. Neurodegeneration in diabetic retinopathy: does it really matter? Diabetologia. 2018 Sep;61(9):1902-1912. https://doi.org/10.1007/s00125-018-4692-1
Celikbilek A, Akyol L, Sabah S, Tanik N, Adam M, Celikbilek M, Korkmaz M, Yilmaz N. S100B as a glial cell marker in diabetic peripheral neuropathy. Neurosci Lett. 2014 Jan 13;558:53-7. https://doi.org/10.1016/j.neulet.2013.10.067
Rübsam A, Parikh S, Fort PE. Role of Inflammation in Diabetic Retinopathy. Int J Mol Sci. 2018 Mar 22;19(4):942. https://doi.org/10.3390/ijms19040942
Cheung AK, Fung MK, Lo AC, Lam TT, So KF, Chung SS, Chung SK. Aldose reductase deficiency prevents diabetes-induced blood-retinal barrier breakdown, apoptosis, and glial reactivation in the retina of db/db mice. Diabetes. 2005 Nov;54(11):3119-25. https://doi.org/10.2337/diabetes.54.11.3119
Ziablitzev SV, Zhupan DB, Dyadyk OO. [The influence of a benzodiazepine receptor agonist on the state of glia in the diabetic retinopathy]. Fiziol Zh. 2023; 69(6): 33-42. Ukrainian. https://doi.org/10.15407/fz69.06.033
Lelyte I, Ahmed Z, Kaja S, Kalesnykas G. Structure-Function Relationships in the Rodent Streptozotocin-Induced Model for Diabetic Retinopathy: A Systematic Review. J Ocul Pharmacol Ther. 2022 May;38(4):271-286. https://doi.org/10.1089/jop.2021.0128
Ziablitsev SV, Zhupan DB, Tykhomyrov AO, Dyadyk OO. Benzodiazepine receptor agonist Carbacetam modulates the level of vascular endothelial growth factor in the retina of rats with streptozotocin-induced diabetes. Ukr Biochem J. 2023.;6(95):20-29. https://doi.org/10.15407/ubj95.06.021
Bogdanov P, Corraliza L, Villena JA, Carvalho AR, Garcia-Arumí J, Ramos D, Ruberte J, Simó R, Hernández C. The db/db mouse: a useful model for the study of diabetic retinal neurodegeneration. PLoS One. 2014 May 16;9(5):e97302. https://doi.org/10.1371/journal.pone.0097302
Sarthy VP, Pignataro L, Pannicke T, Weick M, Reichenbach A, Harada T, Tanaka K, Marc R. Glutamate transport by retinal Muller cells in glutamate/aspartate transporter-knockout mice. Glia. 2005 Jan 15;49(2):184-96. https://doi.org/10.1002/glia.20097
Midena E, Torresin T, Longhin E, Midena G, Pilotto E, Frizziero L. Early Microvascular and Oscillatory Potentials Changes in Human Diabetic Retina: Amacrine Cells and the Intraretinal Neurovascular Crosstalk. J Clin Med. 2021 Sep 7;10(18):4035. https://doi.org/10.3390/jcm10184035
Ziablitsev SV, Vodianyk VV. Retinal apoptosis and the effect of tyrosine kinase inhibition in experimental diabetes. Journal of Ophthalmology (Ukraine). 2023;5(514):34-40. https://doi.org/10.31288/oftalmolzh202353440
Ng YK, Zeng XX, Ling EA. Expression of glutamate receptors and calcium-binding proteins in the retina of streptozotocin-induced diabetic rats. Brain Res. 2004 Aug 20;1018(1):66-72. https://doi.org/10.1016/j.brainres.2004.05.055
Ali SA, Zaitone SA, Dessouki AA, Ali AA. Pregabalin affords retinal neuroprotection in diabetic rats: Suppression of retinal glutamate, microglia cell expression and apoptotic cell death. Exp Eye Res. 2019 Jul;184:78-90. https://doi.org/10.1016/j.exer.2019.04.014
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2024 Зябліцев С. В., Жупан Д. Б.

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Ця робота ліцензується відповідно до ліцензії Creative Commons Attribution 4.0 International (CC BY). Ця ліцензія дозволяє повторно використовувати, поширювати, переробляти, адаптувати та будувати на основі матеріалу на будь-якому носії або в будь-якому форматі за умови обов'язкового посилання на авторів робіт і первинну публікацію у цьому журналі. Ліцензія дозволяє комерційне використання.
ПОЛОЖЕННЯ ПРО АВТОРСЬКІ ПРАВА
Автори, які подають матеріали до цього журналу, погоджуються з наступними положеннями:
- Автори отримують право на авторство своєї роботи одразу після її публікації та назавжди зберігають це право за собою без жодних обмежень.
- Дата початку дії авторського права на статтю відповідає даті публікації випуску, до якого вона включена.
ПОЛІТИКА ДЕПОНУВАННЯ
- Редакція журналу заохочує розміщення авторами рукопису статті в мережі Інтернет (наприклад, у сховищах установ або на особистих веб-сайтах), оскільки це сприяє виникненню продуктивної наукової дискусії та позитивно позначається на оперативності і динаміці цитування.
- Автори мають право укладати самостійні додаткові угоди щодо неексклюзивного розповсюдження статті у тому вигляді, в якому вона була опублікована цим журналом за умови збереження посилання на первинну публікацію у цьому журналі.
- Дозволяється самоархівування постпринтів (версій рукописів, схвалених до друку в процесі рецензування) під час їх редакційного опрацювання або опублікованих видавцем PDF-версій.
- Самоархівування препринтів (версій рукописів до рецензування) не дозволяється.