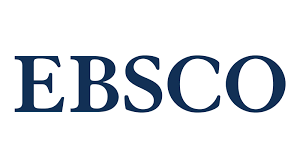Вплив курсового введення мелатоніну на морфофункціональні зміни в зоровому нерві експериментальних тварин із гіпопінеалізмом
DOI:
https://doi.org/10.31288/oftalmolzh202344854Ключові слова:
зоровий нерв, атрофія зорового нерву, цілодобове освітлення, гіпопинеалізм, мелатонін, морфофункціональні зміниАнотація
Актуальність. Розвиток атрофії зорового нерву (АЗН) можна очікувати при гіпопінеалізмі (ГП), який супроводжується дистрофічними змінами в сітківці.
Метою є визначення впливу курсового введення гормону мелатоніну (М) на морфофункціональні зміни в зоровому нерві (ЗН) кролів, що перебувають в умовах тривалого цілодобового освітлення (ЦО) з формуванням ГП.
Матеріал і методи. Проведене експериментальне дослідження в групах: 1) ГЦО – група з 32 кролів з функціональним ГП в умовах ЦО; 2) ГЦО+М - 29 кроликів в умовах ЦО безпосередньо перед виведенням з експерименту отримували курс ін'єкцій М протягом 14 діб. 3) Група контролю (ГК) - 23 інтактні тварини в умовах природної зміни дня та ночі. Залежно від терміну експерименту у кожній групі були виділені підгрупи: 1-2 міс., 3-5 міс., 8-12 міс., 18-19 міс., 26-28 міс. Концентрацію М в крові досліджували імуноферментним методом. Проводили комплексне морфологічне та морфометричне дослідження препаратів ЗН.
Результати. Нічна концетрація М у крові тварин трималась в 6 разів нижчою, ніж контрольна. У тварин в умовах ЦО реєструються до 12 місяців дисциркуляторні розлади у ЗН. Демієлінізація в ЗН була зафіксована з 3-5 місяця експерименту. Перебування тварин в умовах ЦО до 28 місяців супроводжується розвитком склеротичних та атрофічних процесів в ЗН. Морфометрично у підгрупах ГЦО26-28 та ГЦО+М26-28 достовірно зменшуються показники середньої відносної площі судин (2,01±0,15 та 1,93±0,15%), порівняно з ГК26-28 (3,20±0,13%, р<0,05). Показники середньої відносної площі периваскулярної сполучної тканини у підгрупах ГЦО26-28 та ГЦО+М26-28 (4,80±0,15% та 4,61±0,17%) вище показника підгрупи ГК26-28 (3,40±0,14, р<0,05). Середній діаметр пучків нервових волокон у підгрупах ГЦО26-28 та ГЦО+М26-28 (2,51±0,09 ×10-6м та 2,73±0,10×10-6м) були меншими за ГК26-28 (3,85±0.14×10-6м; р<0,05).
Заключення. Виявлені такі морфологічні прояви, як демієлінізація та витончення пучків нервових волокон ЗН у поєднанні із запустінням судин ЗН, потовщенням судинної стінки та розростанням сполучної тканини свідчать про розвиток склеротичної АЗН на фоні вираженого дефіциту М. Курсове введення тваринам М мало протинабрякову дію в ранніх термінах експерименту (до 5 місяців), поки не відбувалися незворотні зміни в ЗН. У тварин з довготривалим гіпопінеалізмом курсове введення М не впливало на розвиток процесів АЗН.
Посилання
Quigley HA, Anderson DR. The histologic basis of optic disk pallor in experimental optic atrophy. Am J Ophthalmol. 1977;83(5):709-17. https://doi.org/10.1016/0002-9394(77)90138-6
Zhaboiedov GD, Skripnik RL. [Lesions of the optic nerve]. Kyiv: Zdorov'ie; 2006. Ukrainian.
Li HJ, Sun ZL, Yang XT, Zhu L, Feng DF. Exploring Optic Nerve Axon Regeneration. Curr Neuropharmacol. 2017; 15(6):861-73. https://doi.org/10.2174/1570159X14666161227150250
Nedzvetskaia OV, Kolot AV, Bondarenko LA. [Study on the morphological characteristics of the retina in experimental hypopinealism]. Oftalmologiia. Vostochnaia Ievropa. 2015; 2(25):35-40. Russian.
Wetterberg L. Light and biological rhythms in man. J Intern Med. 1994; 235(1):5-19. https://doi.org/10.1111/j.1365-2796.1994.tb01027.x
Korf HW, Schomerus C, Stehle JH. The pineal organ, its hormone melatonin, and the photoneuroendocrine system. Adv Anat Embryol Cell Biol. 1998; 146:1-100. https://doi.org/10.1007/978-3-642-58932-4_1
Brainard GC, Hanifin JP, Greeson JM, et al. Action spectrum for melatonin regulation in humans: evidence for a novel circadian photoreceptor. J Neurosci. 2001; 21:6405-12. https://doi.org/10.1523/JNEUROSCI.21-16-06405.2001
Gooley JJ, Rajaratnam SM, Brainard GC. et al. Spectral responses of the human circadian system depend on the irradiance and duration of exposure to light. Sci Transl Med. 2010; 2:31-3. https://doi.org/10.1126/scitranslmed.3000741
Reiter RJ. The pineal gland and melatonin in relation to aging: A summary of the theories and the data. Exp Gerontol. 1995; 30:199-212. https://doi.org/10.1016/0531-5565(94)00045-5
Wiechmann AF, Bok D, Horwitz J. Melatonin-binding in the frog retina: autoradiographic and biochemical analysis. Invest Ophthalmol. 1986; 27:153-63.
Cahill GM, Besharse JC. Light-sensitive melatonin synthesis by Xenopus photoreceptors after destruction of the inner retina. Vis Neurosci. 1992; 8:487-90. https://doi.org/10.1017/S0952523800005009
Martin XD, Malina HZ, Brennan MC. et al. The ciliary body - the third organ found to synthesize indoleamines in humans. Eur J Ophthalmol. 1992; 2:67-72. https://doi.org/10.1177/112067219200200203
Hamm HE, Menaker M. Retinal rhythms in chicks: circadian variation in melatonin and serotonin N-acetyltransferase activity. Proc Natl Acad Sci USA. 1980; 77:4998-5002. https://doi.org/10.1073/pnas.77.8.4998
Ruby NF, Brennan TJ, Xie X et al. Role of melanopsin in circadian responses to light. Science. 2002; 298:2211-13. https://doi.org/10.1126/science.1076701
Claustrat B, Brun J, Chazot G. The basic physiology and pathophysiology of melatonin. Sleep Med Rev. 2005; 9:11-24. https://doi.org/10.1016/j.smrv.2004.08.001
White MP, Fisher LJ. Effects of exogenous melatonin on circadian disc shedding in the albino rat retina. Vision Res. 1989; 29:167-79. https://doi.org/10.1016/0042-6989(89)90122-3
Nickla DL. Ocular diurnal rhythms and eye growth regulation: where we are 50 years after Lauber. Exp Eye Res. 2013; 114:25-34. https://doi.org/10.1016/j.exer.2012.12.013
Pescosolido N, Gatto V, Stefanucci A. et al. Oral treatment with the melatonin agonist agomelatine lowers the intraocular pressure of glaucoma patients. Ophthalmic Physiol Opt. 2015; 35:201-5. https://doi.org/10.1111/opo.12189
Crooke A, Guzman-Aranguez A, Mediero A, Alarma-Estrany P, Carracedo G, Pelaes T, et al. Effect of melatonin and analogues on corneal wound healing: involvement of Mt2 melatonin receptor. Curr Eye Res. 2015; 40:56-65. https://doi.org/10.3109/02713683.2014.914540
Bai J, Dong L, Song Z. The role of melatonin as an antioxidant in human lens epithelial cells. Free Radic Res. 2013; 47:635-42. https://doi.org/10.3109/10715762.2013.808743
Alarma-Estrany P, Pintor J. Melatonin receptors in the eye: location, second messengers and role in ocular physiology. Pharmacol Ther. 2007; 113:507-22. https://doi.org/10.1016/j.pharmthera.2006.11.003
Mishchenko TV, Gladkykh OI, Poltorak VV, Bondarenko LO. [Hypopinealism as a factor of metabolic syndrome]. Endocrynologiia. 2015; 20(2):494-500. Ukrainian.
Bondarenko LA, Gubina-Vakulik, Sotnik NN. [Impact of around-the-clock illumination on circadian rhythm of melatonin and pineal gland structure in rabbits]. Problemy endocrinnoi patologii. 2005; 4:38-45. Ukrainian.
Eren TC, Reiter RJ. Light hygiene: time to make preventive use of insights old and new into the nexus of the drug light, melatonin, clocks, chronodisruption and public health. Med Hypotheses. 2009; 73:537-41. https://doi.org/10.1016/j.mehy.2009.06.003
Bondarenko LA, Sotnyk NM. [Changes in daily hormonal rhythms of the thyroid gland induced by prolonged around-the-clock light exposure]. Problemy endocrinnoi patologii. 2010; 4(34):71-7. Ukrainian. https://doi.org/10.21856/j-PEP.2010.4.10
Nedzvetska OV, Pastukh UA, Kihtenko EV, Pastukh IV, Sotnik NN, Goncharova NA, Kuzmina de Gutarra OV. Morphological and functional changes in the rabbit iris and ciliary body in experimental hypopinealism. J Ophthalmol (Ukraine). 2022; 2(505):42-7. Ukrainian. https://doi.org/10.31288/oftalmolzh202224247
Gubina-Vakulik GI, Bondarenko LA, Sotnik NN. [Prolonged around-the-clock illumination as a factor of accelerated aging of the pineal gland]. Uspekhi gerontologii. 2007; 20(1): 92-5. Russian.
Matviienko AV, Stepanova LV. [Guidelines on preclinical morphological studies in preclinical medication trials]. Kyiv: State Pharmacological Center at the Ministry of Health of Ukraine; 2001. Ukrainian.
Lillie RD. [Histopathologic technic and practical histochemistry]. Moscow: Mir; 1969. Russian.
Sarkisov DS, Perova IuL, editors. [Microscopic technique: a manual]. Moscow: Meditsina; 1996. Russian.
Lapach SN, Chubenko AV, Babich PN. [Statistical methods in medical and biological studies using Excel]. 2nd ed. Kyiv: Morion; 2007. Russian.
Avtandilov GG. [Basics of quantitative pathological anatomy]. Moscow: Meditsina; 2002. Russian.
Sergiienko VI., Bondareva IB. [Mathematical statistics in clinical studies]. Moscow: Geotar Meditsina; 2000. Russian.
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2023 Недзвецька О. В., Пастух У. А., Кузьмина де Гутарра О. В., Пастух І. В., Соболева І. А., Сотник Н. М.

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Ця робота ліцензується відповідно до ліцензії Creative Commons Attribution 4.0 International (CC BY). Ця ліцензія дозволяє повторно використовувати, поширювати, переробляти, адаптувати та будувати на основі матеріалу на будь-якому носії або в будь-якому форматі за умови обов'язкового посилання на авторів робіт і первинну публікацію у цьому журналі. Ліцензія дозволяє комерційне використання.
ПОЛОЖЕННЯ ПРО АВТОРСЬКІ ПРАВА
Автори, які подають матеріали до цього журналу, погоджуються з наступними положеннями:
- Автори отримують право на авторство своєї роботи одразу після її публікації та назавжди зберігають це право за собою без жодних обмежень.
- Дата початку дії авторського права на статтю відповідає даті публікації випуску, до якого вона включена.
ПОЛІТИКА ДЕПОНУВАННЯ
- Редакція журналу заохочує розміщення авторами рукопису статті в мережі Інтернет (наприклад, у сховищах установ або на особистих веб-сайтах), оскільки це сприяє виникненню продуктивної наукової дискусії та позитивно позначається на оперативності і динаміці цитування.
- Автори мають право укладати самостійні додаткові угоди щодо неексклюзивного розповсюдження статті у тому вигляді, в якому вона була опублікована цим журналом за умови збереження посилання на первинну публікацію у цьому журналі.
- Дозволяється самоархівування постпринтів (версій рукописів, схвалених до друку в процесі рецензування) під час їх редакційного опрацювання або опублікованих видавцем PDF-версій.
- Самоархівування препринтів (версій рукописів до рецензування) не дозволяється.